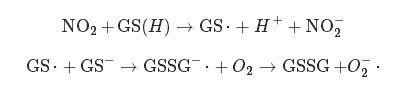Ó idos de Nitrogénio
NO

Mecanismo de Toxicidade
NO2 exógeno [1]
A principal via de entrada do dióxido de nitrogénio é o trato respiratório onde é absorvido aquando da inalação (80-90%) [2]. As maiores concentrações deste composto encontram-se nas vias respiratórias inferiores, e por consequente os danos provocados dão-se principalmente ao nível dos bronquíolos terminais. A absorção do NO2 é regulada por reações químicas com os componentes da camada aquosa de revestimento das mucosas (CARV), devido à sua baixa solubilidade e elevada reatividade [2].
A toxicidade do dióxido de nitrogénio advém da produção de subprodutos resultantes da reação com substratos da CARV, os quais causam peroxidação lipídica com dano da membrana celular, seguindo-se inflamação secundária. Esta última fase caracteriza-se pela libertação de citocinas pró-inflamatórias, prostaglandinas, eicosaónoides, enzimas proteolíticas, assim como pela ativação das células polimorfonucleares [2]. Posteriormente, inicia-se a regeneração dos tecidos danificados com substituição na região alveolar dos pneumócitos danificados tipo I pelos pneumócitos tipo II, capazes de se replicarem rapidamente e que após a descontinuação do NO2 se diferenciam em células tipo I. Nos brônquios as células ciliadas destruídas são substituídas por células Clara não ciliadas, com a capacidade de posteriormente originarem a células ciliadas [4]. Esta fase quando exacerbada, poderá estar na base de doenças crónicas pulmonares [2].
Estudos realizados em ratos, com o objetivo de determinar o mecanismo de toxicidade do dióxido de nitrogénio, demonstraram que a glutationa reduzida (GSH) e antioxidantes, nomeadamente o ácido ascórbico (AA/AH2), presentes na CARV, são responsáveis pela absorção do NO2 por reagirem com este, com consequente formação de subprodutos tóxicos [2]. Estudos in vitro realizados com um modelo da superfície pulmonar, demonstraram que os produtos formados da reação da GSH e AA com o NO2, principalmente os radicais ascorbil(A•−) e tiil da glutationa (GS•) (Figura 1), iniciam uma sequência de reações responsáveis pela oxidação das membranas celulares subjacentes à CARV. As espécies primárias resultantes e responsáveis por iniciar o dano membranar são o superóxido (O2•−), peróxido de hidrogénio e complexos de Fe-O2 (Figura 1) [5].
Figura 1- Reações responsáveis pela absorção do NO2 a nível da camada aquosa de revestimento das mucosas e pela formação de radicais livres capazes de danificarem a membrana celular dos pneumócitos.
Outros mecanismos de toxicidade do dióxido de nitrogénio devem-se à sua reação direta com as proteínas, levando à sua nitrificação [6]; ao dano nos macrófagos alveolares com consequente aumento da susceptibilidade dos indivíduos às infeções [2,7] e à diminuição da capacidade dos pulmões removerem eficientemente partículas inaladas, pela alteração da função de enzimas, macrófagos alveolares e as células epiteliais ciliadas [7]. O CDC (Center for Disease Control and Prevention) propõem ainda a formação de ácido nítrico e nitroso a partir da reação do NO2 com água, apesar de o dióxido de nitrogénio ser pouco solúvel na água [8]. Embora o foco do presente trabalho seja o dióxido de nitrogénio proveniente de fontes exógenas, é importante salientar que o organismo humano consegue produzir este composto, nomeadamente nos processos de inflamação a partir da decomposição do peroxinitrito [9].
Toxicidade – óxido nítrico
O óxido nítrico (NO) apresenta efeitos opostos conforme a sua concentração, podendo
apresentar uma ação antioxidante, oxidante, anti-inflamatória e pró-inflamatória [10].
Na figura 2, observam-se alguns dos efeitos provocados pelo NO. Os efeitos diretos ocorrem,
geralmente, quando o NO se encontra em baixas concentrações e requerem que as
reações químicas sejam rápidas permitindo que o NO exerça efeitos diretamente na biomolécula
alvo. Por outro lado, para concentrações mais elevadas o NO reaje com o oxigénio ou com o
radical anião superóxido, promovendo assim fenómenos de stress oxidativo e nitrosativo[11].
Desta forma, fontes externas de óxido nítrico, quer resultantes da combustão dos combustíveis
fósseis, quer da sua inalação propositada para o tratamento, por exemplo, da hipertensão
pulmonar persistente do recém-nascido, podem levar a que se atinjam concentrações de NO
associadas aos efeitos pró-inflamatórios e oxidantes, e por tal tóxicos [10]. [13]
O NO inalado pode ainda ter efeitos extrapulmonares, nomeadamente alterar o tónus vascular; aumentar o tempo de protrombina, pela inibição da agregação das plaquetas e da adesão às células endoteliais e provocar metahemoglobinemia, uma vez que o na presença de oxigénio, o NO é convertido em nitrato (NO3-) e o ferro do grupo heme é oxidado [10,12], formando-se a metaemoglobina, a qual não transporta oxigénio, podendo originar hipoxia tecidular, principalmente em neonatais por estes apresentam baixa atividade da metahemoglobina redutase, responsável por converter a metahemoglobina em hemoglobina[10].
Os papéis desempenhados pelo NO e os respetivos óxidos de nitrogénio (NOx), tal como o NO2, irão depender dos níveis de concentração endógena, verificando-se a ocorrência natural dos processos fisiológicos ou o desencadeamento de processos fisiopatológicos, consoante estes compostos se encontrem em concentrações normais ou em concentrações alteradas, respetivamente [11].
Figura 2 - Representação esquemática de alguns dos efeitos diretos e indiretos do NO. Adaptado de [11].
Toxicidade do NO2 e NO a nível ambiental [14]
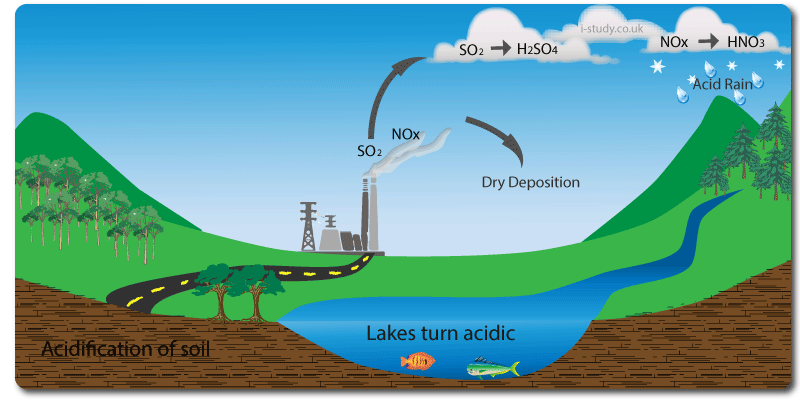
Os efeitos das chuvas ácidas devem-se, tal como o nome indica, ao seu baixo pH. Estas chuvas levam a danos na fauna e flora terrestre e aquática, assim como em bens materiais como edifícios históricos.
[15] [16]
Figura 3- Ciclo de formação das chuvas ácidas. Figura 4 - Efeito das chuvas ácidas na flora.
Os óxidos de nitrogénio, em particular o dióxido de nitrogénio, apresentam uma grande contribuição para a formação destas chuvas. O NO quando libertado, devido à sua instabilidade, é rapidamente transformado em NO2 que em contacto com água leva à formação de ácido nítrico e ácido nitroso, os quais levam à diminuição do pH das chuvas.
2 NO (g) + O2 (g) → 2 NO2 (g)
2 NO2 (g) +H2O (l) → HNO3 (aq) + HNO2 (aq)
EPA Acid Rain Kids site: games and activites!
Referências
[1] Imagem disponível em: http://www.safetysupplywarehouse.com/v/vspfiles/photos/10948-2.jpg. Acedido a 30 de maio de 2014.
[2] Kraft, M. et al. (2005) The German view: Effects of nitrogen dioxide on human health – derivation of health-related short-term and long-term values. Int. J. Hyg. Environ. Health, 208(4), 305–18.
[3] Gallo, M. et al. (2008) Casarett and Doull´s TOXICOLOGY THE BASIC SCIENCE OF POISONS. (7 ed., p. 1148). Nova Iorque: Mc Grall-Hill Companies.
[4] Elsayed, N. (1994) Toxicity of nitrogen dioxide: an introduction. Toxicology, 89(3), 161–74.
[5]Velsor, L. et al. (1997). NO2-induced generation of extracellular reactive oxygen is mediated by epithelial lining layer antioxidants. The American Journal of Physiology, 273. 1265–75.
[6]Gallo, M. et al. (2008) Casarett and Doull´s TOXICOLOGY THE BASIC SCIENCE OF POISONS. (7 ed., p. 57). Nova Iorque: Mc Grall-Hill Companies.
[7] Who working group (1997). Environmental Health Criteria 188, Nitrogen Oxides. (2 ed.) IPCS, International Programme on Chemical Safety, World Health.
[8] ATSDR (2014). ATSDR - Medical Management Guidelines: Nitrogen Oxides. Retirado de http://www.atsdr.cdc.gov/mmg/mmg.asp?id=394&tid=69 a 30 de maio de 2014.
[9] HSDL (2010). Nitrogen Dioxide. Retirado de http://toxnet.nlm.nih.gov/cgi-bin/sis/search/r?dbs+hsdb:@term+@rn+@rel+10102-44-0 a 31 de maio de 2014.
[10] Weinberger et al. (2001). The toxicology of inhaled nitric oxide. Toxicological Sciences : An Official Journal of the Society of Toxicology, 59(1), 5–16.
[11]Thomas, DD. et al. (2008). The Chemical Biology of Nitric Oxide. Implications in Cellular Signaling. Free Radical Biology and Medicine, 45(1), 18-31.
[12] UNEP/ILO/WHO (1997). International Programme on Chemical Safety. Environmental Health Criteria 188: Nitrogen oxides. Retirado de http://www.inchem.org/documents/ehc/ehc/ehc188.htm a 24 de Maio de 2014.
[13] Imagem disponível em: http://blog.cleanenergy.org/files/2012/12/air-pollution-illustration.jpg. Acedido a 30 de maio de 2014.
[14] EPA (2012). Acid Rain: Effects of Acid Rain. Retirado de http://www.epa.gov/acidrain/effects/index.html a 29 de maio de 2014.
[15] Imagem disponível em: http://www.i-study.co.uk/images/images/photo%20album/weather_climate/acid-rain.gif
[16] Imagem disponível em: http://www.environment.ucla.edu/media/images/Fig2_79613-lrg.jpg. Acedido a 30 de maio de 2014